Die Berechnung der Verbrennungsenthalpie
Reaktionsgleichung der Verbrennung von Methan:
CH4 + 2 O2 → CO2 + 2 H2O
Berechnung:
ΔrH° = – 1 mol·ΔfH°m (CH4) + 1 mol · ΔfH°m (CO2) + 2 mol·ΔfH°m (H2O (g))
= 75 kJ – 393 kJ – 484 kJ = – 802 kJ
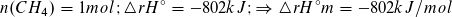
n (CH4) = m/M = 1000 g·mol/16 g = 62,5 mol; ΔrH° = – 802 kJ/mol·62,5 mol
= – 50 125 kJ
Reaktionsgleichung der Verbrennung von Propan:
C3H8 + 5 O2 → 3 CO2 + 4 H2O (g)
Berechnung:
ΔrH° = – 1 mol·ΔfH°m (C3H8) + 3 mol·ΔfH°m (CO2) + 4 mol·ΔfH°m (H2O (g))
= 104 kJ – 1179 kJ – 968 kJ = – 2043 kJ
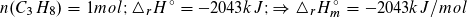
n (C3H8) = m/M = 1000 g · mol/44 g = 22,73 mol; ΔrH° = – 2043 kJ/mol·22,73 mol
= – 46 432 kJ
Bei der Verbrennung von 1 kg Methan wird mehr thermische Energie frei als bei der Verbrennung der gleichen Menge Propan.
Wissensteil:
Bei der Verbrennungsenthalpie handelt es sich um die Reaktionsenthalpie der Reaktion eines Stoffes mit Sauerstoff. Die Reaktionsenthalpien werden aus den molaren Bildungsenthalpien der an der Reaktion beteiligten Stoffportionen berechnet, hierbei gilt allgemein:
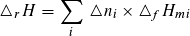
Die Reaktionsenthalpie ist die Summe der Produkte aus Stoffmenge und molarer Bildungsenthalpie der Reaktionsteilnehmer.
Die Vorgehensweise soll am Beispiel der Verbrennung von Propan erläutert werden. Zur Berechnung müssen die molaren Bildungsenthalpien der Verbindungen gegeben sein, die der Elemente in ihrem stabilsten Zustand ist null. Wenn bei der Reaktion Wasser entsteht, muss angegeben sein, ob dessen Aggregatzustand flüssig oder gasförmig ist (beim Kondensieren entsteht zusätzlich Kondensationswärme, die man dann berücksichtigen muss). Ferner benötigt man noch die Reaktionsgleichung:
C3H8 + 5O2 → 3 CO2 + 4 H2O (g)
Der Angabe einer Reaktionsenthalpie liegt immer eine Reaktionsgleichung zugrunde. Es ist zweckmäßig, die Reaktionsenthalpie für die Stoffmengen anzugeben, deren Beträge den Faktoren der Reaktionsgleichung entsprechen. Reagiert z.B. 1 mol Propan mit 5 mol Sauerstoff, so ist Δn (C3H8) = – 1mol und Δn (O2) = – 5 mol, da bei der Reaktion 1 mol Propan und 5 mol Sauerstoff „verbraucht“ werden.
Dabei werden 3 mol Kohlenstoffdioxid und 4 mol Wasserdampf gebildet, es ist also Δn (CO2)= + 3 mol und Δn (H2O (g)) = + 4 mol.
Die Standardreaktionsenthalpie ΔrH° für die Reaktion ergibt sich mit den Tabellenwerten der molaren Standardbildungsenthalpien aus folgender Summe:
ΔrH° = – 1 mol · ΔfH°m (C3H8) – 5 mol · ΔfH°m (O2) + 3 mol · ΔfH°m (CO2) + 4 mol · ΔfH°m (H2O (g))
= – 1 mol (– 104 kJ/mol) – 5 mol (0 kJ/mol) + 3 mol (– 393 kJ/mol) + 4 mol (–242 kJ/mol)
= + 104 kJ – 1179 kJ – 968 kJ = – 2043 kJ
Bei ganz exakter Berechnung müsste noch berücksichtigt werden, dass die Bildungsenthalpien und damit auch die Reaktionsenthalpien temperaturabhängig sind und die Verbrennungsreaktionen üblicherweise nicht bei Standardbedingungen ablaufen. Die dadurch verursachten Abweichungen sind jedoch so gering, dass sich die Standardreaktionsenthalpien mit einem sehr kleinen Verlust an Genauigkeit auf die entsprechenden Reaktionen bei anderen Temperaturen übertragen lassen.

