Die freie Reaktionsenthalpie
Zur Berechnung der Reaktionsenthalpie siehe auch Karte 7 „Die Berechnung der Verbrennungsenthalpie“.
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l)
ΔrH° = – 1 mol·ΔfH°m (C2H5OH) + 2 mol·ΔfH°m (CO2) + 3 mo l·ΔfH°m (H2O)
= 277 kJ – 786 kJ – 858 kJ = – 1367 kJ
ΔrS° = – 1 mol·S°m (C2H5OH) – 3 mol ·S°m (O2) + 2 mol ·S°m (CO2) + 3 mol·S°m (H2O)
= – 1 mol ·161 J/(K·mol) – 3 mol·205 J/(K·mol) + 2 mol·214 J/(K·mol) + 3 mol·70 J/(K·mol)
= – 138 J/K
ΔrG° = – 1367 KJ – 298 K·(– 0,138 kJ/K) = – 1367 kJ + 41 kJ = – 1326 kJ
Wissensteil:
Die Reaktionsenthalpie ist die Summe der Produkte aus Stoffmengenänderung und molarer Standard-Bildungsenthalpie der Reaktionsteilnehmer:
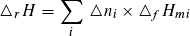
Die Reaktionsentropie ist die Summe der Produkte aus Stoffmengenänderung und molarer Standardentropien der Reaktionsteilnehmer:
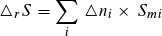
Bei der Berechnung muss beachtet werden, dass die molaren Standard-Entropien der Elemente nicht null sind.
Die freie Standard-Reaktionsenthalpie wird mit Hilfe der Gibbs-Helmholtz-Gleichung berechnet, dabei ist T die Temperatur der thermodynamischen Standardbedingungen
(T = 298 K):
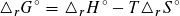
Aus tabellierten Werten der freien Standard-Bildungsenthalpien Δf G°m kann man die freien Reaktionsenthalpien direkt berechnen:
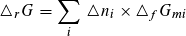
Da für die Verbrennung von Ethanol ΔrG° < 0 ist, liegt eine exergonische Reaktion vor, das heißt, diese Reaktion verläuft bei der Temperatur T (hier: Standardbedingungen) spontan. Damit ist ausgesagt, dass diese Reaktion prinzipiell abläuft, über die Geschwindigkeit des Reaktionsablaufs und eine eventuell erforderliche Aktivierung wird jedoch nichts gesagt. So reagieren z.B. Ethanol und Sauerstoff bei Standardbedingungen ohne Aktivierung nicht miteinander.
Die Feststellung, ob eine Reaktion bei einer bestimmten Temperatur möglich ist oder nicht, ist für die Chemie von grundlegendem Erkenntniswert. Prinzipiell kann eine chemische Reaktion ablaufen, wenn die Entropie in System und Umgebung insgesamt zunimmt, d.h., sie kann auch ablaufen, wenn die Entropie des Systems für sich abnimmt, dann muss jedoch die Zunahme der Entropie der Umgebung überwiegen.
Die Entropieänderung bei einer Reaktion ist
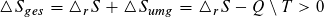
Bei konstantem Druck und Temperatur gilt:
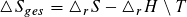 bzw.
bzw. 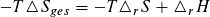
Für das Produkt – TΔ rSges hat der amerikanische Chemiker J. W. Gibbs eine neue Zustandsgröße, die freie Enthalpie G eingeführt, man erhält so die Gibbs-Helmholtz-Gleichung:
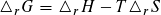
Daraus folgt für spontan ablaufende (exergonische) Reaktionen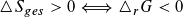 .
.
Nicht spontan ablaufende Reaktionen sind endergonische Reaktionen, für diese gilt ΔrG > 0.

