Enzymhemmung
- Es gibt Inhibitoren der Enzymwirkung, die dem Substrat ähnlich sind und mit diesem um das Bindungszentrum des Enzyms konkurrieren. Sie verdrängen die Substratmoleküle, werden jedoch nicht umgesetzt und hemmen so die Enzymaktivität: kompetitive Hemmung.Alle anderen Faktoren (hohe Temperaturen, kurzwellige Strahlung, Schwermetalle) können ein Enzym denaturieren: Die schwachen Bindungen, die die Raumstrukturen des Enzymproteins stabilisieren, werden gelockert oder gelöst. Wird die Gestalt des Enzyms verformt, wird das Substratmolekül weniger gut passen. Es wird deshalb auch weniger umgesetzt. Ist die Verformung stark, so verliert das Enzym seine Aktivität unumkehrbar. Bei leichten Verformungen können die Bindungen wieder zusammenfinden, das Enzym wird wieder aktiv.
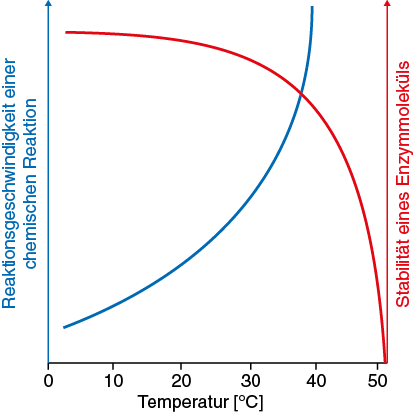
- Die Kurve ist aus zwei Kurven zusammengesetzt. Die blaue Kurve zeigt die Zunahme der Enzymaktivität durch die höhere Energie: Die Bewegung der Teilchen wird schneller, so dass Enzym- und Substratmoleküle häufiger zusammentreffen. Außerdem werden die Bindungen reaktiver. Nach der RGT-Regel erhöht sich die Geschwindigkeit einer enzymkatalysierten Reaktion bei Temperaturerhöhung um 10 °C um das Zwei- bis Vierfache. Die rote Kurve zeigt die Abnahme der Enzym-aktivität durch die Denaturierung des Enzyms.
Wissensteil:
Enzyme sind meistens Proteine. Manche Enzyme enthalten zusätzlich noch eine niedermolekulare Nicht Proteinverbindung – ein Co-Enzym. In Texten erkennt man Enzyme an ihren typischen Namen mit der Endung -ase. (z. B. Katalase, Urease). Die Aufgabe von Enzymen besteht in der Katalyse von Stoffwechselreaktionen. Sie sind biologische Katalysatoren. Ein Katalysator ist ein Stoff, der sich mit einem Substratmolekül verbindet und die Aktivierungsenergie einer chemischen Reaktion senkt. Um Stoffwechselreaktionen mit niedriger Aktivierungsenergie zu bewirken, verbindet sich das Enzym mit dem Substrat zu einem Enzym - Substrat - Komplex . Das Enzym besitzt ein aktives Zentrum; in dieses hinein wird das Substrat chemisch locker gebunden, oft durch recht schwache chemische Bindungen wie Van der Waals Bindungen, Dipol und Wasserstoffbrückenbindungen und Ionenbindungen. Diese Bindungen verändern das Substratmolekül so, dass die gewünschte Spaltung, Synthese oder Umlagerung selbständig abläuft. Das entstandene Produkt wird nicht mehr fest genug gebunden und kann sich durch die thermische Teilchenbewegung entfernen. Das Enzymmolekül steht nun für die nächste Reaktion zur Verfügung. Der Enzym-Substrat-Komplex bildet sich beim Zusammentreffen von Substrat und Enzym. Für die Wahrscheinlichkeit eines solchen Zusammentreffens spielt die Temperatur eine entscheidende Rolle: Höhere Temperatur bedeutet höhere Teilchenbewegung, und das bedeutet wiederum höhere Reaktionsgeschwindigkeit. Die RGT - Regel, die allerdings nur von ca. 0 °C – 40 °C gilt, besagt: Bei einer Temperaturerhöhung von 10°C verdoppelt sich die Reaktionsgeschwindigkeit. Nach Ablauf der Reaktion wird das Enzym unverändert aus dem Komplex freigesetzt. Als Enzymhemmung oder Inhibition bezeichnet man die Herabsetzung der katalytischen Aktivität eines Enzyms durch einen Hemmstoff. Enzymatische Reaktionen können auf ganz verschiedene Wegen gehemmt werden, die wichtigsten davon sind:
- Kompetitive Hemmung: Ein Molekül – der Inhibitor – ähnelt dem Substrat und kann im aktiven Zentrum des Enzyms anstelle des Substrats eingebaut werden. Substrat und Inhibitor konkurrieren um den Platz am Enzym. Der Inhibitor wird zwar nicht verarbeitet, verhindert aber die Bindung des Substrats. Auf diese Art kann eine enzymatische Reaktion über die Konzentration des Inhibitors stufenlos gebremst werden!
- Allosterische Hemmung: Bei dieser Hemmung wird der Inhibitor an einer anderen Stelle gebunden als das Substrat. Dadurch wird das aktive Zentrum so verändert, dass die Reaktion nicht mehr abläuft. Diese Form tritt häufig auf als Produkthemmung: Das Produkt hemmt ein Enzym des Stoffwechselweges, der zu diesem Produkt führt. So wird eine Anhäufung von Produkten in der Zelle automatisch verhindert.
Grundlegend unterscheidet man dabei zwischen reversibler und irreversibler Hemmung. Bei letzterer geht der Inhibitor eine stabile Verbindung mit dem Enzym ein. Bei der reversiblen Hemmung kann der Enzym - Inhibitor - Komplex wieder in seine Bestandteile zerfallen.
Alle Stoffe und Bedingungen, die Proteine stören bzw. zerstören, beeinträchtigen die Funktion der Enzyme, z. B. hohe und tiefe Temperaturen, Säuren, Basen, Schwermetalle, organische Phosphorverbindungen. Diese Faktoren wirken unspezifisch, also zum Beispiel durch Veränderung der räumlichen Struktur, der Konformation des Enzyms Sie treffen viele oder alle Enzyme einer Zelle gleichermaßen.

