Kalk und hartes Wasser
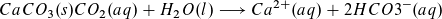
- Beim Austritt des kalkhaltigen Wassers, z. B. an der Höhlendecke, kommt die Lösung in einen Bereich mit geringerem CO2 -Partialdruck, zusätzlich erwärmt sie sich und beim Herabtropfen oder Herabfließen kommt es zur Aufwirbelung der Lösung. All dies führt zu einer Freisetzung von Kohlenstoffdioxid aus der Lösung und ruft eine Gleichgewichtsverschiebung nach links hervor, da nach Braun und Le Chatelier eine aus dem Gleichgewicht entfernte Komponente durch das System nachgebildet wird. So entsteht auch vermehrt Calciumcarbonat, das ausfällt. (Siehe auch Karteikarte „Das chemische Gleichgewicht und die Beeinflussung seiner Lage“).
- Beispiel 1: Beeinträchtigung der Waschwirkung von Seife durch hartes Wasser, Bildung von Kalkseife. Die in hartem Wasser vorhandenen Ca2+- (und Mg2+)-Ionen reagieren mit den Seifenanionen zu nicht löslicher, waschinaktiver Kalkseife:
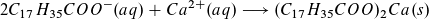
Dies führt zu einem erhöhten Verbrauch an Seife, da die Seife ihre Waschwirkung erst dann entfalten kann, wenn alle Calciumionen ausgefällt sind.
Beispiel 2: Beim Erhitzen von hartem Wasser in Boilern, Waschmaschinen oder Kesselanlagen kommt es zu Kalkablagerungen durch die Verschiebung des Gleichgewichts durch entweichendes Kohlenstoffdioxid.
Wissensteil:
Der natürliche Kreislauf des Kalks
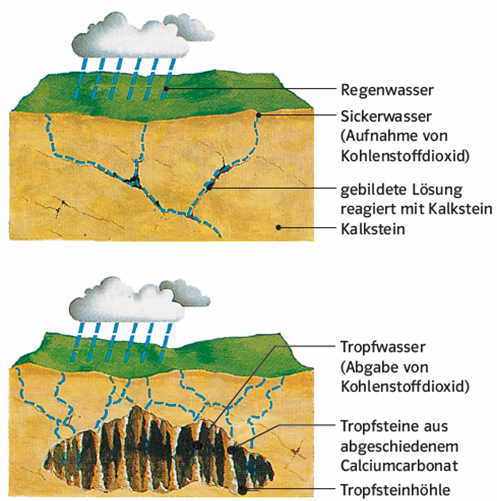
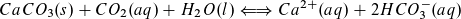
Regenwasser nimmt beim Durchgang durch die Luft Kohlenstoffdioxid auf und erhält dadurch einen pH-Wert von etwa 5,7. Das Bodenwasser ist darüber hinaus durch Huminsäuren und durch Kohlenstoffdioxid aus dem Abbau organischen Materials sauer. Kommt dieses Wasser mit Kalkstein in Berührung, reagiert das schwer lösliche Calciumcarbonat zu hydratisierten Calcium- und Hydrogencarbonationen. Dabei stellt sich ein chemisches Gleichgewicht ein.
Die durch gelöstes Calciumcarbonat hervorgerufene Wasserhärte bezeichnet man als temporäre Härte, da sie durch Kochen (Gleichgewichtsverschiebung!) beseitigt werden kann. Sind daneben noch Sulfationen gelöst, z. B. durch Lösen von Gips, CaSO4 , so wird die dadurch hervorgerufene Wasserhärte als permanente Härte bezeichnet, da sie durch Kochen nicht beseitigt werden kann. Beide „Härten“ zusammen ergeben die Gesamthärte des Wassers.
Auswirkungen des harten Wassers
Seife kann ihre Waschwirkung (Oberflächenspannung herabsetzen, Schmutz dispergieren) nur ausüben, wenn freie, hydratisierte Seifenanionen vorliegen. Dies kann man z. B. daran erkennen, dass weiches Wasser mit etwas Seife geschüttelt, Schaum erzeugt. Im Gegensatz dazu erfolgt dies in hartem Wasser nicht, man beobachtet jedoch weiße Flöckchen von Kalkseife. Erst wenn alle Ca2+ - (und Mg2+ )-Ionen zu Kalkseife reagiert haben, können weitere Seifenanionen ihre Waschwirkung entfalten. Die Folge ist ein hoher Seifenverbrauch, bevor die Waschwirkung überhaupt einsetzt. Gelegentlich lagern sich die Kristalle der Kalkseife auch im Gewebe als harte Krusten ab, sodass das Gewebe im Laufe der Zeit vergraut, verfilzt und brüchig wird, da die Ablagerungen einzelne Fasern der Fäden zerschneiden. Auch verliert die Wäsche ihre Saugfähigkeit.
Die Gleichgewichtsverschiebung durch das Erhitzen von hartem Wasser führt zu Kalkablagerungen in Gefäßen, auf Heizstäben und in Rohren. Die Ablagerungen führen zu einer wesentlich schlechteren Übertragung von thermischer Energie auf die aufzuheizende Flüssigkeit, dies zieht einen höheren Energieverbrauch und schließlich auch Defekte nach sich. In Rohren wird der Querschnitt verengt, sodass weniger Wasser fließen kann.

