Wissensteil:
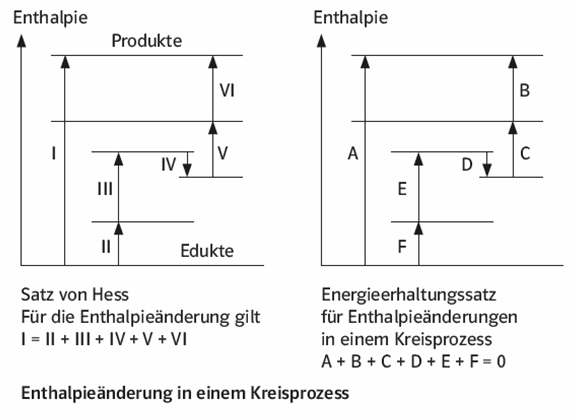
Die Lösung der Aufgabe erfolgt mit einer Anwendung des Satzes von Hess: „Die Enthalpieänderung zwischen zwei Zuständen ist unabhängig vom Reaktionsweg“. Diese Formulierung ist ein „Spezialfall“ des Energieerhaltungssatzes (oder Ersten Hauptsatzes der Energetik), der besagt, dass die Summe aller Energiearten in einem isolierten System konstant ist.
Wenn also zum Beispiel bei zwei verschiedenen Reaktionsführungen die Ausgangs- und die Endzustände jeweils miteinander übereinstimmen, dann muss die Enthalpieänderung für beide Vorgänge gleich sein, unabhängig davon, über welche Zwischenschritte oder auf welchen Wegen der Endzustand erreicht wurde. Hieraus ergibt sich auch, dass die Enthalpieänderungen für eine Hin- und Rückreaktion im Betrag gleich, im Vorzeichen aber verschieden sind.
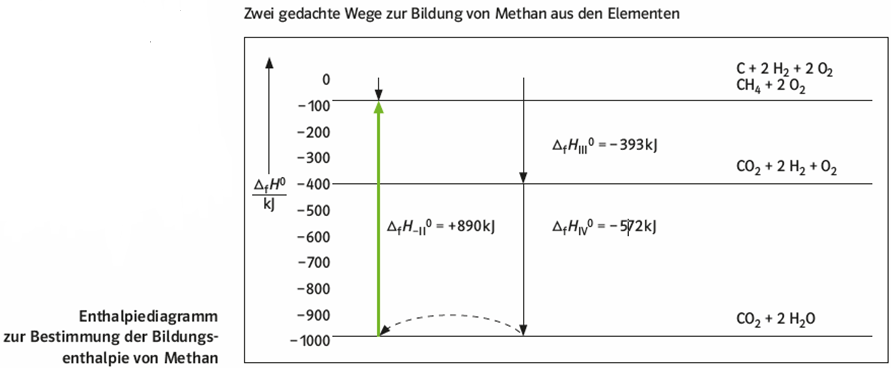
Daraus resultiert, dass die Summe aller Enthalpieänderungen bei einer Folge von chemischen Reaktionen gleich null ist, wenn am Ende der Ausgangszustand wieder vorliegt. Eine solche Reaktionsfolge bezeichnet man als Kreisprozess.