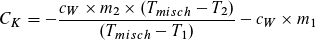Die Berechnung der Verbrennungsenthalpie
Bei der Verbrennung freigesetzte thermische Energie:
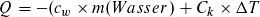
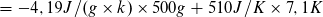
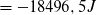
Stoffmenge der Stoffportion Schwefel:
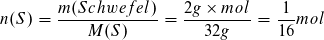
Molare Bildungsenthalpie:
Für n (S) = 1 mol ergibt sich eine molare Bildungsenthalpie
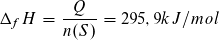
Wissensteil:
Die Reaktionsenthalpie beim Verbrennen eines Stoffes kann in Verbrennungskalorimetern ermittelt werden.
Der Stoff reagiert im Sauerstoffstrom zu heißen, gasförmigen Verbrennungsprodukten. Diese werden durch eine Kühlspirale geleitet und geben dabei ihre Wärme an das Wasser ab. Allerdings wird dabei häufig ein kleiner Teil der Verbrennungsenthalpie nicht erfasst, z.B. beim Einbringen der brennenden Stoffportion und beim Ableiten der nicht vollständig abgekühlten Verbrennungsgase. Werden elementare Stoffe, wie Kohlenstoff oder Schwefel, mit reinem Sauerstoff verbrannt, so kann aus der gemessenen Wärmemenge die molare Bildungsenthalpie ΔfH ermittelt werden.
Für die Umsetzung gilt: Die vom gesamten System aufgenommene und experimentell bestimmbare Wärme ist dem Betrag nach gleich der Reaktionswärme Q. Sie setzt sich aus der vom Wasser aufgenommenen Wärme QW und der vom Kalorimetergefäß aufgenommenen Wärme QK zusammen:
Q = QW + QK = cW · mW · ΔT + CK · ΔT = (cW · mW + CK) ΔT
Es bedeuten mW: Masse des Wassers; ΔT: Temperaturdifferenz zwischen Endtemperatur T2 und Anfangstemperatur T1:
ΔT = T2 – T1 ; cW = 4,1868 J/(g · K): spezifische Wärmekapazität des Wassers, gerundet 4,19 J/(g · K); CK ist die Wärmekapazität des Kalorimetergefäßes. Sie wird vor der eigentlichen Messung experimentell ermittelt.
Bestimmung der Wärmekapazität CK:
Gießt man 100 g Wasser von 60 °C in ein mit 100 g Wasser von 20 °C gefülltes Kalorimeter, so erhält man nicht 200 ml Wasser von 40 °C, sondern von einer etwas niedrigeren Temperatur. Das warme Wasser erwärmt nicht nur das kalte Wasser, sondern auch das Kalorimeter. Nimmt dieses bei einer Temperaturerhöhung um ΔT die Wärme Q auf, so ist der Quotient Q/ΔT = CK , die Wärmekapazität des Kalorimeters. Um diese zu bestimmen, wird Wasser der Masse m1 und der Temperatur T1 eingefüllt. Danach wird eine gleich große Portion warmen Wassers der Temperatur T2 hinzugefügt und die Mischungstemperatur Tmisch gemessen. Das warme Wasser gibt die Wärme Q2 ab (Q2 ist negativ):
Q2 = cW · m2 · (Tmisch – T2)
Das kältere Wasser und das Gefäß nehmen Wärme auf:
Q1 = (cW · m1 + CK) · (Tmisch – T1)
Mit Q1 + Q2 = 0 (Energieerhaltung) ergibt sich eine Gleichung,
die nach CK aufgelöst werden kann: