Bestimmung des Kalkgehalts durch Rücktitration
- Reaktionsgleichung:
CaCO3 + 2 H3O+ + 2 Cl– → Ca2+ + 2 Cl– + CO2 + 3 H2O
Die Gasentwicklung wird durch entweichendes Kohlenstoffdioxid hervorgerufen.
- Berechnung der Stoffmenge der reagierenden Oxoniumionen:
Da die Salzsäure und die Natronlauge in derselben Konzentration eingesetzt werden, neutralisieren sich gleiche Volumina der beiden Lösungen. Das Volumen der zugesetzten Natronlauge entspricht somit dem Volumen der Salzsäure, die nach beendeter Reaktion mit dem Kalk übrig geblieben ist.
Demnach ist:
V (Salzsäure, reagiert) = V1 (Salzsäure, eingesetzt) – V2 (Natronlauge) = 20 ml – 1,8 ml = 18,2 ml.
n (HCl, reagiert) = c·V = 1 mol/l·0,0182 l = 0,0182 mol = n (H3O+, reagiert).
Berechnung der Stoffmenge des in der Probe enthaltenen Kalks:
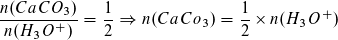
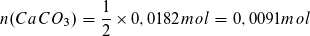
Berechnung der Masse des Kalks in der Probe:
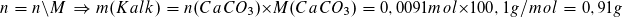
Berechnung des Massenanteils:
w(Kalk) = m(Kalk)/m (Probe) · 100% = 0,91 g/1 g · 100% = 91%
Wissensteil:
Diese Rücktitration besitzt eine große Bedeutung bei der Bestimmung des Kalkgehalts von Böden. Dieser spielt für die landwirtschaftliche Nutzung und für eine sinnvolle und gezielte Düngung eine Rolle. Auch die Belastbarkeit des Bodens durch sauren Regen hängt wesentlich von seinem Kalkgehalt ab, der aus der Verwitterung von kalkhaltigem Gestein herrührt, auf dem der Boden entstanden ist.
Die Berechnung um die Rücktitration wird zunächst dadurch vereinfacht, dass die eingesetzten sauren und alkalischen Lösungen die gleichen Konzentrationen besitzen. Da nach der Neutralisationsgleichung H3O+ + OH- → 2 H2O ein Oxoniumion mit einem Hydroxidion reagiert, reagieren auch gleiche Stoffmengen der Ionen miteinander. Gleich große Volumenportionen mit gleichen Stoffmengenkonzentrationen besitzen gleiche Stoffmengen an reagierenden Teilchen.
Beispiel: V (Salzsäure) = 50 ml; c (H3O+) = 1 mol/l
Mit c = n/V und n = c · V ergibt sich n (H3O+) = 1 mol/l · 0,05 l = 0,05 mol.
Entsprechend ist bei V (Natronlauge) = 50 ml und c (OH-) = 1 mol/l auch n (OH-) = 0,05 mol.
Die verwendete Relation n (HCl) = n (H3O+) gilt allgemein nur für einprotonige starke Säuren. Hintergrund ist die Protolysereaktion, die zu den Oxoniumionen führt und nur bei starken Säuren zu 100% abläuft, sodass z.B. aus 1000 Chlorwasserstoffmolekülen auch 1000 Oxoniumionen entstehen:
HCl (g) + H2O (l) → H3O+ (aq) + Cl-(aq).
Den Bezug von der durch die Reaktion verbrauchten Volumenportion an Salzsäure zu der ehemals vorliegenden Kalkportion erhält man über die Stoffmengenrelation, die auf der Basis der Reaktionsgleichung aufgestellt werden kann:
CaCO3 + 2 H3O+ + 2 Cl- → Ca2++ 2 Cl- + CO2 + 3 H2O
Man erkennt, dass eine Elementargruppe Calciumcarbonat mit zwei Oxoniumionen reagiert. Entsprechend ist die Stoffmengenrelation:
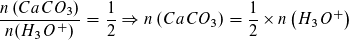
Daraus lässt sich die Masse des enthaltenen Kalks und anschließend der Massenanteil des Kalks an der Probe berechnen. Dieser Zahlenwert kann als Dezimalzahl oder in Prozent angegeben werden (0,91 oder 91%).

