Titration einer Glycinlösung
- Die Carboxylatgruppen der Glycin-Zwitterionen reagieren mit Oxoniumionen der Salzsäure.

Das Gleichgewicht liegt zu Beginn des Experimentes nahezu vollständig auf der rechten Seite.
- Es werden zwei Gleichgewichte betrachtet.
a) Im sauren Bereich:
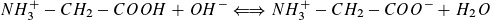
Das Gleichgewicht verlagert sich bei Zugabe von OH--Ionen immer weiter nach rechts. Nach Zugabe von 20 ml Natronlauge liegt es nahezu vollständig auf der rechten Seite.
b) Im alkalischen Bereich:
Nachdem die Carboxylgruppen nahezu vollständig reagiert haben, setzt die Protolyse der NH3 +-Gruppen ein.

Das Gleichgewicht verlagert sich bei Zugabe von OH--Ionen immer weiter nach rechts. Nach Zugabe von 40 ml Natronlauge liegt es nahezu vollständig auf der rechten Seite.
- Beim ersten Wendepunkt (pH ≈ 2,3) liegt ein äquimolarer Puffer vor.
Es gilt:
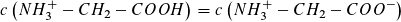
Der zweite Wendepunkt (pH ≈ 6) kennzeichnet den Isoelektrischen Punkt. Hier erreicht die Konzentration der Zwitterionen ein Maximum. Beim dritten Wendepunkt (pH ≈ 9,8) liegt ein äquimolarer Puffer vor.
Es gilt:
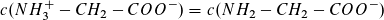
Wissensteil:
Die Titrationskurve von Glycin zeigt zwei Abschnitte, in denen sich der pH-Wert nur geringfügig verändert.
Hier liegen Puffergleichgewichte vor. In dem Abschnitt dazwischen verändert sich der pH-Wert
sprunghaft. Es liegt nahezu keine Pufferwirkung vor.
Eine entsprechende Lage der Wendepunkte ergäbe sich auch bei der umgekehrten Titration einer alkalischen Lösung der Aminosäure mit Salzsäure.
Dafür lassen sich die folgenden Puffergleichgewichte formulieren, auf die die Henderson-Hasselbach-Gleichung angewandt werden kann:
a)
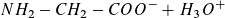

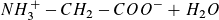
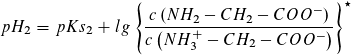
Für 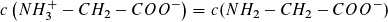 , also am Wendepunkt 3,
, also am Wendepunkt 3,
gilt pH2 = pKs2 (= 9,78, Literaturwert)
und
b)
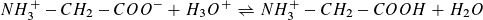
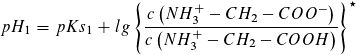
Für 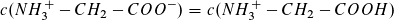 , also am Wendepunkt 1,
, also am Wendepunkt 1,
gilt pH1 = pKs1 (= 2,35, Literaturwert)
*) Die geschweiften Klammern geben an, dass nur der Zahlenwert der Konzentrationen eingesetzt wird.

