pKs -und pKB-Werte
- Für den Zusammenhang zwischen pKS- und KSWert bzw. pKB- und KB-Wert gilt:
pKS = – lg {KS} pKB = – lg {KB}
KS= 10–pKS mol·l–1 KB = 10–pKB mol·l–1
pKS (HCOOH) = 3,75 pKB (HCOO–) = 10,25
KS = 10–3,75 mol·l–1 KB = 10–10,25 mol·l–1
- Natriumhydrogensulfat ist ein Salz, das in wässriger Lösung in Natrium- und Hydrogensulfationen zerfällt.
NaHSO4 → Na+ + HSO4–
Die Natriumionen gehen keine Säure-Base-Reaktion mit Wassermolekülen ein. Das Hydrogensulfation ist eine starke Säure, deshalb ist eine Natriumhydrogensulfat-Lösung sauer.
HSO4– + H2O → SO42- + H3O+
Natriumhydrogencarbonat ist ein Salz, das in wässriger Lösung in Natrium- und Hydrogencarbonationen zerfällt.
NaHCO3 → Na+ + HCO3–
Die Hydrogencarbonationen können sowohl als Base als auch als Säure reagieren. Allerdings ist der pKB-Wert des Hydrogencarbonats kleiner als der pKS-Wert: 7,48 <10,40.
(Allerdings ist der KB-Wert des Hydrogencarbonats größer als der KS-Wert: 10–7,48 > 10–10,40.)
Hydrogencarbonat reagiert daher in einer Gleichgewichtsreaktion mit Wasser als Base, es werden Hydroxidionen gebildet, die die Lösung alkalisch machen.

Wissensteil:
Säure- und Basekonstanten. Will man die Stärke verschiedener Säuren bzw. Basen miteinander vergleichen, muss man ihre Reaktionen mit der derselben Base bzw. Säure betrachten. Als Bezugsbase und Bezugssäure hat man den Ampholyten Wasser gewählt. Wendet man das Massenwirkungsgesetz auf das Gleichgewicht einer Säure bzw. Base mit Wasser an, so erhält man:
Reaktion einer Säure HA mit Wasser: Reaktion einer Base B mit Wasser:
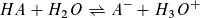
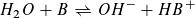
Massenwirkungsgesetz: Massenwirkungsgesetz:
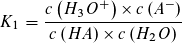
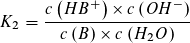
Wie beim Ionenprodukt des Wassers kann in verdünnter wässriger Lösung die Konzentration des Wassers als konstant angesehen werden und mit der Gleichgewichtskontanten K1 bzw. K2 zu einer neuen Konstanten KS bzw. KB zusammengefasst werden.
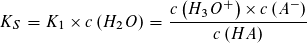
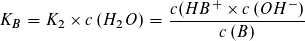
Die Gleichgewichtskonstanten KS und KB bezeichnet man als Säurekonstante bzw. Basekonstante. Beide
Konstanten sind von der Art der Säure bzw. Base und von der Temperatur abhängig, jedoch unabhängig von der Konzentration der Säure oder Base.
Säure- und Basekonstante sind ein Maß für die Säure- und Basestärke. Je höher der KS- bzw. der KB-Wert ist, umso stärker ist die Säure bzw. Base.
Statt der Konstanten KS und KB gibt man häufig die mit – 1 multiplizierten dekadischen Logarithmen ihrer Zahlenwerte an:
Säureexponent: Baseexponent:
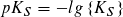
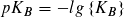
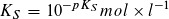
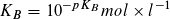
Je kleiner der pKS- bzw. pKB-Wert ist, desto größer ist die Stärke einer Säure bzw. einer Base. pKS- und pKB-Werte ermöglichen eine Einteilung von Säuren und Basen nach ihrer Stärke.
Der pKS-Wert einer Säure HA und der pKB-Wert ihrer korrespondierenden Base A- hängen in einfacher Weise voneinander ab:
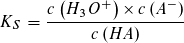
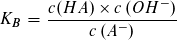
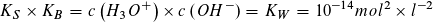
bzw.: pKS + pKB = pKW = 14
Das Produkt aus KS- und KB-Wert eines korrespondierenden Säure-Base-Paares ergibt stets den Wert des Ionenproduktes des Wassers: Bei 25 °C ist dieses KS · KB = KW = 10-14 mol2 · l-2.
Ist also der pKS-Wert einer Säure bekannt, so kann man mit der Gleichung pKS + pKB = pKW = 14 den pKB-Wert der korrespondierenden Base berechnen (und umgekehrt). Aus der Gleichung geht auch hervor:
Je stärker eine Säure ist, umso schwächer ist ihre korrespondierende Base.
Je stärker die Base ist, umso schwächer ist ihre korrespondierende Säure.

