Ammoniak-Titration
- C ist der „Neutralpunkt“. Dieser liegt immer bei einem pH-Wert pH = 7 vor.
D ist der „Äquivalenzpunkt“. Bei der Reaktion der Ammoniaklösung mit Salzsäure entsteht Ammoniumchlorid. Das Ammoniumion ist eine schwache Säure, deshalb liegt der pH-Wert im sauren Bereich.
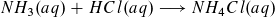
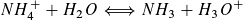
- Bei der Titration entstehen in zunehmender Konzentration NH4+-Ionen, zurück bleiben mit abnehmender Konzentration NH3-Moleküle, die noch nicht reagiert haben. Es entsteht somit eine Pufferlösung, für deren pH-Wert gilt:
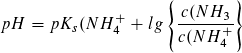
Im Bereich des Punktes B, d. h. bei pH = pKS und c (NH3) = c (NH4+), erniedrigt sich der pH-Wert bei Zugabe von Salzsäure am wenigsten, hier besitzt die Lösung ihre größte Pufferkapazität.
Wissensteil:
Am Äquivalenzpunkt beträgt der Salzsäureverbrauch V (Salzsäure) = 25 ml. Es lässt sich mit den Angaben des Textes und der Volumenermittlung auch die Ausgangskonzentration c0(NH3) berechnen. 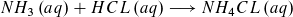
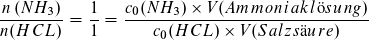
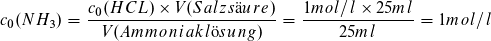
Man kann nun auch den pH-Wert am Äquivalenzpunkt berechnen, wenn der KS-Wert KS (NH4+) = 10-9,25 mol/l bekannt ist. Da die entstandene Lösung von Ammoniumchlorid ein Volumen V = 50 ml hat, ist die Konzentration c (NH 4 Cl) = 0,5 mol/l.
Wegen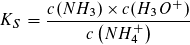 und
und 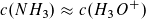 ist c2 (H3O+) = KS · V(NH4CL)
ist c2 (H3O+) = KS · V(NH4CL)
Daraus folgt: 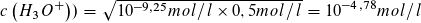
pH = 4,78
Auch der pH-Wert der Ausgangslösung lässt sich berechnen.
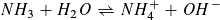
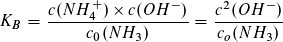
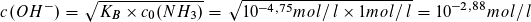
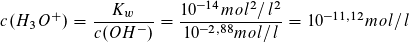
pH=11,12

